Revue
A. Bahadi,1 O. Maoujoud,1 Y. Zejjari,1 A. Alayoud,1 K. Hassani,1 D. Elkabbaj 1 et M. Benyahia 1
مراجعة
تشخيص وتقييم فيروس التهاب الكبد سي بين مرضى الديال الدموي
عبدالعالي بهادي، عمر موجود، ياسر زيجاري، أحمد العيود، كوتر حساني، دريس الكباج، محمد بن يحيى
الخلاصـة: يُعَدُّ التهاب الكبد "سي" من المشكلات الصحية الواسعة الانتشار في شتى أرجاء العالم. وتقدِّر منظمة الصحة العالمية أن %3 من سكان العالم مصابون بالعدوى بفيروس التهاب الكبد "سي". ولدى مرضى الدِّيال، قد يصل معدل العدوى في بعض البلدان إلى %80، وفي المغرب يصل إلى %32 وفق السجل المغربي للدِّيال. وتتَّسم السيرة الطبيعية للعدوى بالتهاب الكبد "سي" لدى مرضى الدِّيال الدموي المزمن بتفاقم صامت. وهناك طرق مختلفة لتشخيص التهاب الكبد "سي" وحساسيتها تتزايد باطراد، وهناك اختبارات غير مباشرة لأضداد الفيروس "سي" لالتهاب الكبد، ويمكن تكرارها، ولكن تشيع النتائج السلبية الكاذبة؛ وهناك طرق غير مباشرة لاختبار الرنا الفيروسي، وهي طرق أكثر حساسية ولكنها لا تكون متوافرة دائماً، وتكون أغلى ثمناً من غيرها. وقد تم تصنيف استعمالات هذه الاختبارات من خلال التوصيات الجديدة التي أصدرتها الجمعيات العلمية؛ إلا أن تقييم أمراض الكبد لايزال موضع جدل، ولاتزال خزعة الكبد تمثِّل المعيار الذهبي. وتستعرض هذه الورقة أساليب تشخيص وتقييم مرضى التهاب الكبد "سي" الخاضعين للدِّيال الدموي.
RÉSUMÉ RÉSUMÉ L’hépatite virale C constitue un problème de santé à l’échelle mondiale. L’Organisation mondiale de la Santé estime que 3 % de la population mondiale est infectée par le virus de l’hépatite C (VHC). Chez les hémodialysés, la prévalence atteint 80 % dans certains pays. Au Maroc, la prévalence est de 32 % selon le registre marocain de dialyse. L’histoire naturelle de l’infection par le virus de l’hépatite C chez l’hémodialysé chronique est caractérisée par une évolution silencieuse. Les moyens de diagnostic du VHC sont divers et de plus en plus sensibles : les tests indirects à la recherche des anticorps anti-VHC qui sont reproductibles mais les cas de faux négatifs sont très fréquents, et les tests directs recherchant l’ARN viral qui sont de plus en plus sensibles mais ne sont pas toujours disponibles et ont un coût élevé. L’utilisation de ces tests a été codifiée grâce aux nouvelles recommandations des sociétés savantes. Cependant, l’évaluation de l’atteinte hépatique demeure controversée et la ponction-biopsie hépatique reste le gold standard. Cet article passe en revue les approches pour le diagnostic et l’évaluation de l’hépatite C chez l’hémodialysé.
Diagnosis and evaluation of hepatitis C virus among haemodialysis patients
ABSTRACT Hepatitis C is a health problem worldwide. The World Health Organization estimates that 3% of world’s population is infected with hepatitis C virus (HCV). In haemodialysis patients, the prevalence reaches 80% in some countries. In Morocco, HCV prevalence is 32% according to the Moroccan register of dialysis. The natural history of hepatitis C infection in chronic haemodialysis patients is characterized by a silent evolution. There are different methods to diagnose HCV and they are becoming increasingly sensitive. There are indirect tests for antibodies to HCV: these are reproducible but false negatives are common and there is direct testing of viral RNA: this is more sensitive but not always available and is more expensive. The use of these tests has been categorized through new recommendations from learned societies. However, the evaluation of liver disease is still controversial and liver biopsy remains the gold standard. This paper reviews the approaches for diagnosing and evaluating hepatitis C in haemodialysis patients.
1Service de Néphrologie, Dialyse et Transplantation rénale, Hôpital militaire d’instruction Mohammed V, Rabat (Maroc) (Correspondance à adresser à A. Bahadi :
This e-mail address is being protected from spambots. You need JavaScript enabled to view it
).
Reçu : 28/02/12; accepté : 19/06/12
EMHJ, 2013, 19(2):192-199
Introduction
Depuis que Freinstone et al. [1] ont mis en évidence, en 1975, l’existence d’un nouvel agent inconnu causant des hépatites non A non B, baptisées NANBH (Non-A, Non-B Hepatitis), plusieurs études ont permis de faire certaines avancées [2-5]. Mais l’avancée majeure fut la caractérisation du génome du virus par Choo et al. en 1989 [6]. L’agent causal des NANBH, ainsi identifié, prit alors le nom de virus de l’hépatite C (VHC). D’un point de vue médical et épidémiologique, cette découverte permit de mettre au point un test ELISA pour détecter la présence du VHC chez les patients et surtout de tester les produits sanguins, et donc d’éliminer la première cause de transmission du virus dans les pays développés [7].
L’infection par le virus de l’hépatite C (VHC) est considérée comme un problème majeur de santé publique à l’échelle mondiale. L’Organisation mondiale de la Santé estime qu’environ 3 % de la population générale est infectée par ce virus, avec de 130 à 170 millions de porteurs chroniques [8]. En dialyse, le problème est beaucoup plus ample, avec une prévalence qui peut atteindre 80 % et une incidence de plus de 9 % par an [9-12]. Au Maroc, en estime que la prévalence de l’hépatite virale C en dialyse est de 32 % et l’incidence de 9,4 % par an, d’où l’intérêt de cette question.
Diagnostic dans la population générale
Le test de diagnostic le plus utilisé est la recherche des anticorps dirigés contre les protéines virales par méthode indirecte, notamment par ELISA. Ce test utilise une plaque imprégnée de protéines du virus (représenté dans la figure 1 par des triangles). Le sérum du patient est ajouté à cette plaque. Si ce sérum contient un anticorps anti-VHC, ce dernier va se fixer aux protéines virales. Ce complexe est détecté ensuite par un anticorps spécifique et cette fixation va entraîner un changement de coloration du marqueur (Figure 1).

La sensibilité de l’ELISA est proche de 100 % chez les immunocompétents mais peut être faussement négative ou positive chez les immunodéprimés et au cours des maladies auto-immunes [13]. Cependant, un anti-VHC positif ne renseigne pas sur le caractère aigu ou chronique de l’infection et encore peut être faussement positif. Pour cela, il est indispensable de réaliser un test de confirmation par la recherche d’acide nucléique. Ce test direct pourra faire la part entre une infection guérie quand la recherche est négative et une infection évolutive quand on détecte l’acide ribonucléique (ARN) viral (Figure 2).
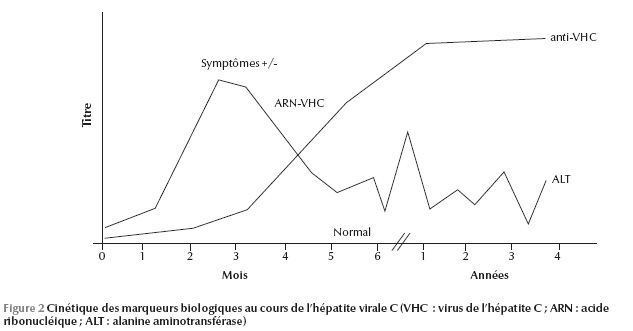
Dans ce cadre, plusieurs tests ont été développés avec un seuil de détection qui ne cesse de baisser, en particulier la PCR (Polymerase Chain Reaction) en temps réel avec un seuil qui atteint 12 UI/mL (Tableau 1). Ces tests directs sont sensibles mais ne sont pas toujours disponibles et posent le problème de coût élevé. Il fallait donc trouver d’autres marqueurs fiables et reproductibles, surtout dans les laboratoires où on ne dispose pas de techniques de biologie moléculaire. Pour cela, Tanaka et al. ont évalué un nouveau test biologique qui permet de détecter l’antigène core du virus et ont trouvé une corrélation linéaire entre les concentrations de l’antigène core et de l’ARN pour les génotypes 1, 2 et 3 [14]. Cette recherche a été ensuite combinée avec la recherche d’anticorps pour développer le test ELISA 4e génération.
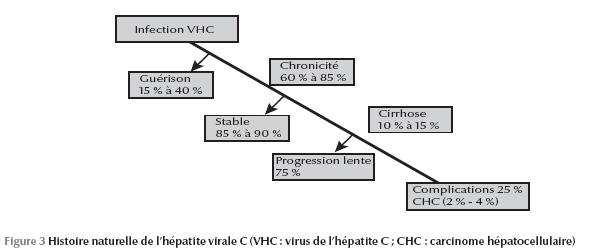
À travers ces moyens de diagnostic direct et indirect, on a pu identifier, avec presque certitude, l’histoire naturelle du VHC dans la population générale (Figure 3). Malgré ces moyens de plus en plus sensibles, Lerat et al. ont mis en évidence une nouvelle entité biologique qui échappe aux moyens de diagnostic direct et indirect : l’hépatite C occulte [15]. Les auteurs ont recherché l’ARN viral dans le tissu hépatique et dans les cellules mononucléées périphériques chez 100 patients ayant une élévation inexpliquée des transaminases et chez lesquels la recherche d’anticorps et de l’ARN viral dans le sérum était négative : 57 % avaient l’ARN viral au niveau de leur tissu hépatique.
Diagnostic chez l'hémodialysé chronique
L’histoire naturelle de l’hépatite virale C chez l’hémodialysé est, par contre, caractérisée par une évolution à bas bruit. En effet, et comme l’ont démontré Fabrizi et al. depuis 10 ans, le taux des transaminases est bas au cours de l’insuffisance rénale chronique (IRC) [16]. Cette diminution a été attribuée à la carence en vitamine B6 et à la présence de toxines urémiques dans le sang qui pourrait altérer la détection des transaminases [17-19]. Cependant, on a remarqué que malgré cette baisse, le taux des transaminases est élevé chez les patients IRC porteurs d’une hépatite C en comparaison avec les anti-VHC négatifs même dans la fourchette normale du laboratoire. Gouveia et al. ont comparé le taux d’ALAT (alanine aminotransférase) chez 202 hémodialysés dont 15 anti-VHC positifs [20]. Les auteurs ont constaté que le rapport des ALAT sur la limite supérieure de la normale est de 0,7 chez les patients infectés par le virus. Ils ont conclu qu’un taux dépassant 70 % de la limite supérieure normale du laboratoire est fortement prédictif d’hépatite virale C avec une sensibilité de 67 % et une spécificité de 75 %.
Comme dans la population générale, le diagnostic de l’hépatite virale C par les anticorps anti-VHC est confronté à de faux positifs et de faux négatifs, avec un taux de 4 % et 9 % respectivement [21]. On peut donc conclure que la PCR est le moyen idéal pour détecter précocement une hépatite C. Cependant, la recherche d’ARN viral n’est pas toujours disponible aux laboratoires, surtout en périphérie, et a un impact économique considérable. Fabrizi et al. ont voulu savoir si l’antigène du virus de l’hépatite C peut améliorer la situation. Ils ont constaté que dans la population des hémodialysés aussi, il y avait une corrélation linéaire entre l’antigène core et l’ARN viral [22]. Ce travail confirme la fiabilité et la forte sensibilité du test ELISA de 4e génération chez les hémodialysés. Sur le plan pratique, l’apport de ce test a été étudié récemment en Inde chez 250 hémodialysés chroniques(HDC) [23]. Dans ce travail, on a remarqué que 13 patients négatifs pour l’anticorps contre le virus de l’hépatite C (Ac anti-VHC) ont été détectés par l’antigène core malgré la faible charge virale. Les auteurs ont suivi ces patients pendant six mois et ont constaté que ce test a permis le diagnostic précoce de quatre patients (six mois avant).
Malgré tous ces moyens, de plus en plus pertinents, l’hépatite virale C est peut être sous-estimée en hémodialyse. Barril et al. ont recherché l’infection par le virus de l’hépatite C occulte chez 109 patients ayant une élévation des enzymes hépatiques inexpliquée [24]. L’ARN viral a été recherché dans les cellules mononucléées sanguines périphériques. Cette recherche était positive chez 45 patients et 26 patients seulement étaient positifs par PCR en temps réel. Alors que faire pour dépister le VHC en hémodialyse ?
Recommandationsde dépistage
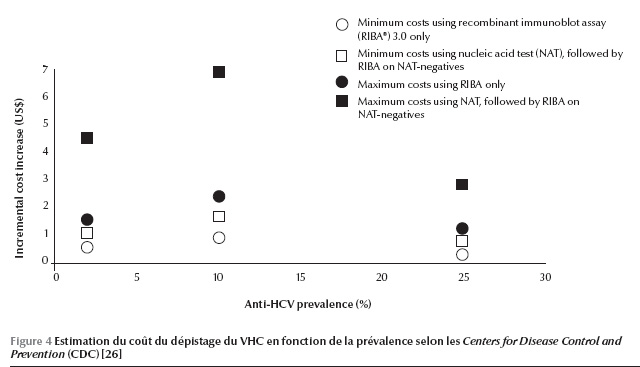
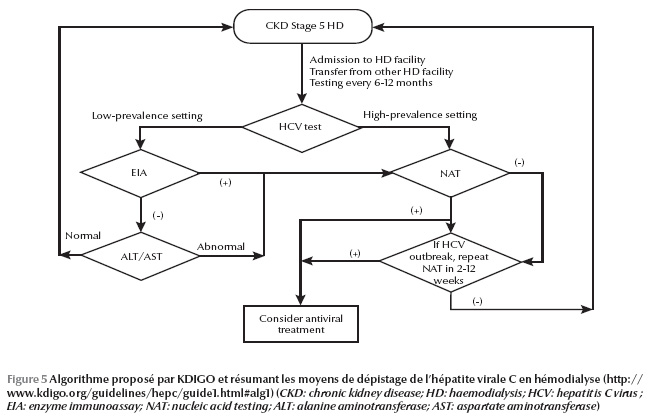
Un grand nombre d’experts en la matière se sont réunis dans le cadre de la Fondation KDIGO (Kidney Disease : Improving Global Outcomes) pour établir des recommandations concernant la prévention, le diagnostic, l’évaluation et le traitement de l’hépatite virale C [25]. Selon ces recommandations, les patients en hémodialyse chronique (maladie rénale chronique stade 5D) doivent être testés pour le VHC à l’initiation de l’hémodialyse ou lors du transfert d’une autre unité d’hémodialyse (recommandation forte). Reste le moyen de diagnostic ou de dépistage : faut-il rechercher l’anticorps ou l’ARN viral ? Dans les études publiées, la sensibilité des méthodes immuno-enzymatiques varie entre 53 et 100 % et la spécificité entre 85 et 99 %. Si on considère la prévalence au centre de dialyse, on constate que le nombre de faux négatifs augmenteavec la prévalence de l’hépatite C dans le centre. De plus, selon une étude réalisée par les Centers for Disease Control and Prevention (CDC) (Figure 4), le coût du dépistage augmente en cas de recherche d’acide nucléique, en particulier si la prévalence est basse [26]. En s’appuyant sur ces deux considérations, on recommande que dans les unités d’hémodialyse où la prévalence du VHC est basse, la recherche du virus devrait être initiée par un test immuno-enzymatique (suivi en cas de positivité par un test moléculaire à la recherche de l’ARN du VHC) (recommandation modérée). Dans les unités d’hémo-dialyse où la prévalence du VHC est élevée, un test moléculaire doit être envisagé d’emblée (recommandation modérée).
Pour le suivi, il est conseillé de retester tous les 6 à 12 mois par test immuno-enzymatique les patients en hémodialyse qui sont négatifs pour le VHC (recommandation modérée) et un test moléculaire pour le VHC doit être réalisé chez les patients hémodialysés qui ont une élévation inexpliquée des transaminases plasmatiques (recommandation forte). Cependant, si un nouveau cas d’infection VHC dans une unité d’hémodialyse est suspecté d’être nosocomial, tous les patients qui pourraient avoir été exposés au VHC doivent être soumis à un test moléculaire (recommandation forte). Un deuxième test moléculaire est suggéré 2 à 12 semaines après un premier test négatif (recommandation faible). Un algorithme a été également proposé par ces experts, dans lequel on a repris toutes ces recommandations (Figure 5).
Évaluation de l’hépatite virale C chez l’hémodialysé
Après diagnostic positif de l’hépatite virale C chez un patient en hémodialyse, l’évaluation d’un hémodialysé porteur d’une hépatite virale consiste en ce qui suit [27] :
Recherche de co-infection par le VHB (virus de l’hépatite B), le VIH (virus de l’immunodéficience humaine)
Détermination de la charge virale par PCR-RT
Identification du génotype
Évaluation de la maladie hépatique
Plaquettes, taux de prothrombine (TP), bilirubine, albumine, échographie
Ponction-biopsie hépatique/ FibroTest® et FibroScan®.
Concernant la charge virale, des précautions sont nécessaires ; notamment, les prélèvements doivent être réalisés avant le branchement car l’héparine inhibe la transcriptase inverse (reverse transcriptase- RT) et pourrait contribuer à de faux négatifs ou à réduire la charge virale. La centrifugation doit être réalisée en moins de 4 heures après prélèvement et la conservation après, de préférence, à moins de 20 °C [26].
Le problème majeur est : comment évaluer la fibrose ? La ponction-biopsie hépatique (PBH) est le gold standard pour évaluer la sévérité de l’atteinte hépatique par le VHC [28]. Elle permet l’évaluation de la sévérité de l’inflammation, la recherche de maladie associée et surtout la mesure de la fibrose (stade). Pour cela, on s’est basé depuis plusieurs années sur le score de Ishak et surtout le score Métavir [29,30] qui évaluent la fibrose en quatre stades et l’activité en trois stades.
Dans la population des hémodialysés, cet examen invasif peut aboutir à de nombreuses complications, surtout hémorragiques. Ozdogan et al. ont recensé les complications de la PBH chez 150 patients, dont 74 patients atteints d’IRC [31]. Les auteurs ont été confrontés à sept complications hémorragiques daIRC alors qu’aucun saignement n’a été objectivé chez le groupe témoin. Mais c’est un risque potentiel puisque des études récentes ont démontré que le risque est moins important que dans la population générale. Dans une étude randomisée, publiée il y a 2 ans, et qui incluait plus de 300 patients dont 78 hémodialysés, Pawa et al. ont démontré que la PBH était sans risque chez les hémodialysés [32].
De plus, la PBH transjugulaire reste un moyen alternatif en cas de risque hémorragique accru surtout chez les patients obèses, en présence d’ascite ou en cas de thrombopénie. Dans ce cadre, Ahmad et al. ont comparé les complications de la PBH entre deux groupes : 46 patients ayant bénéficié d’une PBH par voie transjugulaire et 32 patients d’une PBH par voie percutanée [33]. Il n’y avait aucune différence statistique entre les deux groupes. Les résultats sont surprenants puisqu’aucune complication hémorragique n’a été recensée dans le groupe de PBH par voie transjugulaire. La différence entre les deux groupes est significative.
Le problème majeur de la PBH reste sa reproductibilité. Calès et al. ont démontré la grande variabilité du diagnostic histologique en pratique courante [34]. En effet, dans cette série de 205 hépatites chroniques C, le diagnostic initial fait par le pathologiste généraliste ou de première ligne a été comparé à celui d’une relecture par un expert du groupe Métavir. Si l’accord n’est pas mauvais aux stades extrêmes, il devient très médiocre pour les stades intermédiaires, en particulier pour le stade 2, puisque lorsque l’expert dit stade 2, le pathologiste de première ligne peut dire 0, 1, 2, 3, ou 4 ! Ceci explique que la concordance globale en pratique courante est médiocre, donc insuffisante.
D’autres moyens biologiques pour évaluer la fibrose ont prouvé leur efficacité dans la population générale et le FibroTest® en est le chef de file. Varaut et al. ont utilisé ce test et ont retrouvé que pour 50 hémodialysés chroniques et 60 transplantés, 88 % et 77 % des patients respectivement ont été correctement classés par rapport au score Métavir [35]. Et on remarque aussi que la valeur prédictive positive est augmentée quand le score est plus important (score > 0,6). D’autres tests biologiques ont été étudiés mais aucune corrélation n’a été retrouvée avec le degré de fibrose hépatique chez l’hémodialysé [36].
L’élastométrie impulsionnelle ultrasonore représente une nouvelle étape dans le développement de tests diagnostiques non invasifs de la fibrose hépatique. Avec un résultat instantané, une technique indolore non invasive, renouvelable et un apprentissage aisé, l’élastométrie hépatique est véritablement le « stéthoscope hépatologique », avec déjà de nombreuses applications.
La valeur de l’élastométrie impulsionnelle n’a été évaluée au cours de la maladie rénale qu’une seule fois par Alric et al. [37]. En effet, les auteurs ont démontré chez 38 transplantés que le FibroScan® a permis la classification correcte dans 90 % des cas en cas de fibrose minime (< F2). Cependant, le diagnostic est incorrect dans environ 40 % des patients avec fibrose sévère (F3/F4).
Avec un but diagnostique, le FibroScan® pourrait être complémentaire des tests biologiques, chacun ayant ses propres limites. Pour cela, Castéra et al. ont étudié la sensibilité et la spécificité de l’association de ces deux moyens [38]. Les auteurs ont constaté que le stade de fibrose a été correctement établi par cette association dans 88 % et 95 % des cas de fibrose débutante et avancée respectivement. Il est donc trop tôt pour préciser la place de ces tests non invasifs par rapport à la biopsie hépatique et jusqu’à ce jour, il n’y a pas de recommandation claire concernant ce sujet. Selon l’AASLD (American Association for the Study of Liver Diseases), la ponction-biopsie hépatique chez un hémodialysé doit être discutée au cas par cas [39].
Conclusion
L’hépatite virale C constitue un souci majeur en dialyse. Les moyens diagnostiques ont bénéficié des progrès de la biologie moléculaire, cependant beaucoup de questions restent sujets de controverse, notamment l’hépatite occulte. Concernant l’évaluation de la fibrose hépatique, il est trop tôt pour préciser la place des tests non invasifs par rapport à la biopsie hépatique chez l’hémodialysé.
Références
- Freinstone SM et al. Transfusion associated hepatitis not due to viral hepatitis A or B. New England Journal of Medicine, 1975, 292:767–770.
- Alter HJ et al. Transmissible agent in non-A, non-B hepatitis. Lancet, 1(8062):459–463.
- André P et al. Characterization of low- and very-low-density hepatitis C virus RNA-containing particles. Journal of virology, 2002, 76(14):6919–6928.
- Bartenschlager R et al. Nonstructural protein 3 of the hepatitis C virus encodes a serine-type proteinase required for cleavage at the NS3/4 and NS4/5 junctions. Journal of virology, 1993, 67(7):3835–3844.
- Behrens SE, Tomei L, De Francesco R. Identification and properties of the RNA-dependent RNA polymerase of hepatitis C virus. The EMBO Journal, 1996, 15(1):12–22.
- Choo QL et al. Isolation of a cDNA clone derived from a blood-borne non-A, non-B viral hepatitis genome. Science, 1989, 244(4902):359–362.
- Kuo G et al. An assay for circulating antibodies to a major etiologic virus of human non-A, non-B hepatitis. Science, 1989, 244(4902):362–364.
- Organisation mondiale de la Santé. Document WHA62/22. Hépatite virale [Viral hepatitis]. Soixante-Deuxième Assemblée mondiale de la Santé, Genève, 2009 (http://apps.who.int/gb/ebwha/pdf_files/A62/A62_22-fr.pdf, consulté le 29 octobre 2012)
- Fabrizi F, Poordad FF, Martin P. Infection and the patient with end-stage renal disease. Hepatology (Baltimore, Md.), 2002, 36(1):3–10.
- Magredial (Maroc Greffe et Dialyse) Registre de l’Insuffisance rénale chronique terminale [Morocco Dialysis and Transplant « Magredial » Registry]. Rabat, Ministère de la Santé, Direction des Hôpitaux et des Soins ambulatoires (Communication orale des résultats de 2005), 2009.
- Sekkat S et al. Prévalence des anticorps anti-VHC et incidence de séroconversion dans cinq centres d’hémodialyse au Maroc [Prevalence of anti-HCV antibodies and seroconversion incidence in five haemodialysis units in Morocco]. Néphrologie & Thérapeutique, 2008, 4(2):105–110.
- Fissell RB et al. Patterns of hepatitis C prevalence and seroconversion in hemodialysis units from three continents: The DOPPS. Kidney International, 2004, 65:2335–2342.
- NIH Consensus Statement on Management of Hepatitis C: 2002. NIH Consensus and State-of-the-Science Statements, 2002, 19(3):1–46 (http://consensus.nih.gov/2002/2002HepatitisC2002116PDF.pdf, accessed 7 September 2012).
- Tanaka E et al. Evaluation of a new enzyme immunoassay for hepatitis C virus (HCV) core antigen with clinical sensitivity approximating that of genomic amplification of HCV RNA. Hepatology (Baltimore, Md.), 2000, 32:388–393.
- Lerat et al. Occult hepatitis C virus infection in patients in whom the etiology of persistently abnormal results of liver-function tests is unknown. Journal of Infectious Diseases, 2004, 189(1):3–6; 7–14.
- Fabrizi F et al. Decreased serum aminotransferase activity in patients with chronic renal failure: Impact on the detection of viral hepatitis. American Journal of Kidney Diseases, 2001, 38(5):1009–1015.
- Perico N et al. Infection and Chronic Renal Diseases. Clinical Journal of the American Society of Nephrology; CJASN, 2009, 4:207–220.
- Tang S, Lai KN. Chronic viral hepatitis in hemodialysis patients. Hemodialysis International. International Symposium on Home Hemodialysis, 2005, 9:169–179.
- Furusyo N et al. Liver damage in hemodialysis patients with hepatitis C virus viremia: A prospective 10-year study. Digestive Diseases and Sciences, 2000, 45:2221–2228.
- Cavalcanti Gouveia E et al. Identificacao de ponto de corte no nivel serico da alanina aminotransferase para rastreamento da hepatite C em pacientes com insuficiencia renal cronica em hemodialise [Identification of the cutoff value for serum alanine aminotransferase in hepatitis C screening of patients with chronic renal failure on hemodialysis]. Revista da Sociedade Brasileira de Medicina Tropical, 2004, 37:18–21.
- Hanuka N et al. Hepatitis C virus infection in renal failure patients in the absence of anti-hepatitis C virus antibodies. Journal of Viral Hepatitis, 2002, 9(2):141–145.
- Fabrizi F et al. Novel assay using total hepatitis C Virus (HCV) core antigen quantification for diagnosis of HCV infection in dialysis patients. Journal of Clinical Microbiology, 2005, 43(1):414–420.
- Medhi S et al. Diagnostic utility of hepatitis C virus core antigen in hemodialysis patients. Clinical Biochemistry, 2008, 41:447–452.
- Barril I et al. Occult hepatitis C virus infection among hemodialysis patients. Journal of the American Society of Nephrology, 2008, 19:2288–2292.
- KDIGO clinical practice guidelines for the prevention. diagnosis, evaluation, and treatment of hepatitis C in chronic kidney disease. Kidney International. Supplement, 2008, (109):S1–S99.
- Recommendations for preventing transmission of infections among chronic hemodialysis patients. MMWR Recommendations and Reports, 2001, 50(RR–5):1–43.
- Perico N et al. Infection and Chronic Renal Diseases. Clinical Journal of the American Society of Nephrology; CJASN, 2009, 4:207–220.
- Saleh HA, Abu-Rashed AH. Liver biopsy remains the gold standard for evaluation of chronic hepatitis and fibrosis. Journal of Gastrointestinal and Liver Disease, 2007, 16:425–426.
- Ishak K et al. Histological grading and staging of chronic hepatitis. Journal of Hepatology, 1995, 22:696–699.
- Bedossa P, Poynard T. An algorithm for the grading of activity in chronic hepatitis C. The METAVIR Cooperative Study Group. Hepatology (Baltimore, Md.), 1996, 24:289–293.
- Ozdogan M et al. H. Telatar percutaneous liver biopsy complications in patients with chronic renal failure. Nephron, 1996, 74:442–443.
- Pawa S et al. percutaneous liver biopsy is safe in chronic hepatitis C Patients with end-stage renal disease. Clinical Gastroenterology and Hepatology, 2007, 5(11):1316–1320.
- Ahmad A et al. Transjugular liver biopsy in patients with end-stage renal disease. Journal of Vascular and Interventional Radiology, 2004, 15:257–260.
- Calès P et al. Reproductibilité des examens usuels pour la fibrose hépatique en pratique clinique : PBH, tests sanguins et Fibroscan. [Reproductibility of routine examinations for liver fibrosis in clinical practice: liver biopsy, blood tests and Fibroscan]. Communication orale présentée aux Journées francophones de pathologie digestive (JFPD) (Résumé), Paris, 2008 (http://www.biols.fr/uploads/rte/File/JFPD2008VARIOB9.pdf, consulté le 29 octobre 2012).
- Varaut A et al. Diagnostic accuracy of the fibrotest in hemodialysis and renal transplant patients with chronic hepatitis C virus. Transplantation, 2005, 80(11):1550–1555.
- Boyacioğlu S et al. Investigation of possible clinical and laboratory predictors of liver fibrosis in hemodialysis patients infected with hepatitis C virus. Transplantation proceedings, 2004, 36(1):50–52.
- Alric L et al. Comparison of liver stiffness, fibrotest and liver biopsy for the assessment of liver fibrosis in renal transplant patient with chronic viral hepatitis. Transplant International, 2009, 22(5):568–573.
- Castéra L et al. Prospective comparison of transient elastography, fibrotest, APRI, and Liver biopsy for the assessment of fibrosis in chronic hepatitis C. Gastroenterology, 2005, 128:343–350.
- Ghany MG et al. Diagnosis, management, and treatment of hepatitis C: an update. Hepatology (Baltimore, Md.), 2009, 49:1335–1373.




 Volume 31, number 5 May 2025
Volume 31, number 5 May 2025 WHO Bulletin
WHO Bulletin Pan American Journal of Public Health
Pan American Journal of Public Health The WHO South-East Asia Journal of Public Health (WHO SEAJPH)
The WHO South-East Asia Journal of Public Health (WHO SEAJPH)